İLAÇLARDA FAYDA-ZARAR ORANI NEDİR?
Prof. Dr. F. Cankat Tulunay
Son günlerde tüm dünyada olduğu gibi COVİD aşılarının aşılanan kişilerde kalp hastalıklarına ve hatta kansere sebep olduğuna ve bu yan etkilerin uzun süre sonra bile ortaya çıkabileceği yorumları haklı olarak özellikle mRNA aşısı yapılanlarda ciddi endişelere sebep olmuş ve olmaya da devam etmektedir.
Bugüne kadar maalesef yan etkisi olmayan bir ilaç keşfedilemedi. Her ilacın, her tıbbi müdahalenin az veya çok zararı vardır. Bu zararı en aza indirmek için özellikle bu ilaçlara ruhsat veren kurumların ilaç piyasaya çıkmadan önce fayda-zarar oranın değerlendirmesi gerekmektedir. Bazı ilaçlarda başlangıçta ilacın faydası zararından daha üstün bulunsa da, aylar ve hatta yıllar sonra ilacın çok ciddi yan etkileri ortaya çıkabilir. Bu tip ilaçlara ait örnekler tabloda verilmiştir.
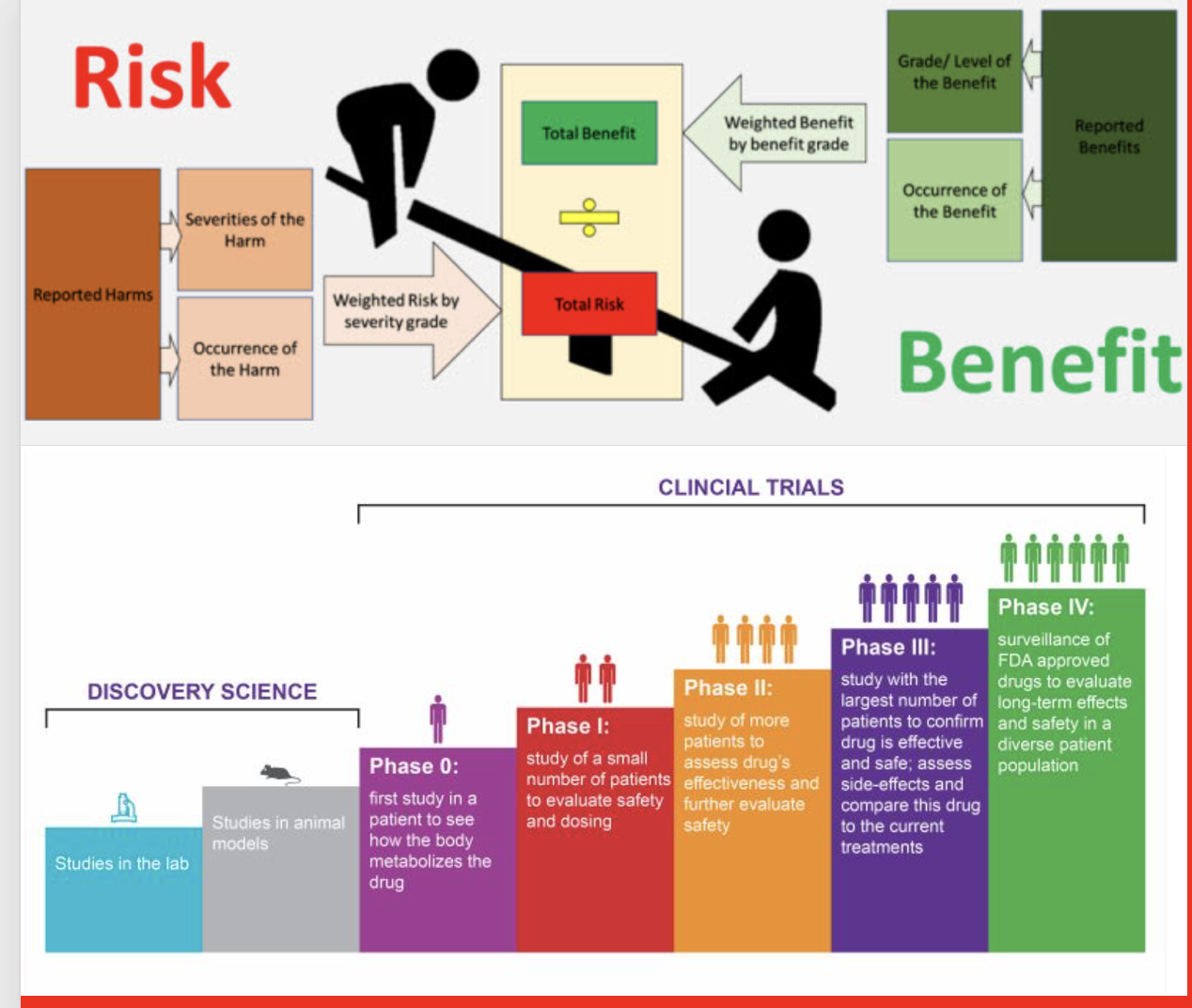
Fayda-risk değerlendirmesi, bir ilacın beklenen olumlu etkilerinin (klinik etkinlik, semptom azaltımı, hastalığın ilerlemesinin önlenmesi) ile ilişkili olumsuz etkilerinin (advers reaksiyonlar, toksisite, uzun vadeli komplikasyonlar) niteliksel ve/veya niceliksel olarak analiz edilmesi sürecidir. Bu değerlendirme, hasta popülasyonunun özellikleri, tedavi bağlamı, mevcut alternatif tedaviler ve bilimsel belirsizlikler gibi faktörleri dikkate alır. Amaç, bireysel ve toplumsal düzeyde tedavinin net faydasını belirlemek; örneğin, bir ilacın onaylanması, geri ödeme listelerine girmesi, kısıtlanması veya piyasadan çekilmesi kararlarının alınmasında mutlak değerlendirilmesi gereken bir konudur.
- Tüm dünyada düşük ve orta gelirli ülkelerde yılda 134 milyon istenmeyen ilaç reaksiyonu, 2.6 milyon ölüm
- Avrupa birliği: 29.3 milyon istenmeyen ilaç yan etkisi, senede 197.000 ölüm ve tahmine 79 milyar ekonomik kayıp.
- ABD: İstenmeyen ilaç reaksiyonları (ADR)
- Hastaneye yatışların %5-12 sini (senede 2.2 milyon kişi) teşkil eder ve hastaneye ADR sebebi ile yatanlarda %0.32 ölümle sonuçlanır.
- Hastaneye müracaat eden 1000 hastadan 6 sı ADR sebebiyledir ve bunların %38’i hastaneye yatırılır
- FDA/CDC 2024 verilerine göre ADR ye baylı senelik ölüm 106.00-120.000 kişi. ASP (American Society of Pharmacists) 2025 tahminlerine göre senede 250.000-300.000 ölüm. Bu rakam ADR ölümlerini ABD de üçünü ölüm sırasına sokar
- ADR/ADE ye bağlı morbidite ve mortalite maliyeti 136 milyar dolar
- TÜRKİYE: HİÇ BİR RESMİ BİLGİMİZ YOK!
İlaç olabilecek bir kimyasal molekül önce in vivo ve in vitro olarak (deney tüplrinde ve hayvan deneylerinde) etkileri ve toksisiteleri yönünden ciddi testlerden geçirilir. Bu testlerde uygun görülen moleküller fayda-zarar yönünden değerlendirilir ve uygun preklinik bilgiler ilaç otoritelerine (FDA, EMA gibi) detaylı bir rapor olarak IND (investigational new drug- yeni araştırma ilacı) olarak sunulur ve ilacın ilk insan kullanımı başlar.İlaçlar insanlar üzerinde üç dönemde değerlemdirilir ve bunlara FAZ çalışmalı denir. 1. Fazda ilaç az sayıda normal sağlıklı deneklerde (bazen hastalarda) denenir, bunda uygun sonuş alınırsa Faz2 çalışması denen az sayıda hastada denenir ve uygun bulunanlar bazen binleri bulan hastalar üzerinde denenir. Bir ilaç molekülü bütün bu safhaları başarı ile geçerse insanda kullanılmak üzere ruhsat müracaatında bulunur. Bilimsel komisyonlar bütün dökümanları inceleyerek ilacın fayda/zarar oranı hesaplanarak faydası zararlarından daha fazla ise insanda kullanılmasına karar verir.
Bütün bu testlere ve değerlendirmelere rağmen neden ilaç yan etkileri ölümlere dahi sebep olmakta? Yapılan tüm Faz çalışmalarında tüm yan etkileri tesbit etmek mümkün değildir. Faz çalışmaları seçilmiş hastalar üzerinde yapılır. İlaç piyasaya çıkınca binlerce-onbinlerce birbirinden çok farklı hastalarda kullanılır. Hastaların kullandığı ilaçlar, gıda takviyeleri, beslenmeleri, genetik yapıları, sosyal durumları gibi çok farklı faktörler ilaç cevabını önemli ölçüde değiştirebilir. Nadir yan etkiler faz çalışmaları sırasında tesbit edilemez, bunlar ancak ilacın yaygın kullanımı sırasında ortaya çıkar. Benzer şekilde hastanın diğer hastalıklarını etkileme, diğer hastalıklarında kullandığı diğer ilaçlarla etkileşimi ancak ‘’real word’’ (gerçek yaşam) şartları altında kullanımında ortaya çıkar. Bu sebeplerle bir çok ülke periypdik olarak rahsatlı ilaçları fayda-zarar oranın yönünden değerlendirir. Periyodik safety update reports (PSUR, Periyodik Güvenlik Güncelleme Raporu) hazırlar. Bu raporlar hasta ve halk sağlığı yönünden çok önemlidir. Bu raporları hazırlayabilmek için o ülkede güvenilir bir ‘’PHARMACOVIGILANCE’’ (ilaç güvenliği) organizasyonu olması gerekir. İlacın kullanımı sırasında ortaya çıkan yan etkilerin doktorlar, eczacılar ve hastalar tarafından ilgili kuruma bildirilmesi gerekir. Ayni zamanda ilaç firmalarının da topladıkları yan etkileri daha doğrusu beş yıllık fayda-zarar oranı değerlendirmesini ilaç otoritesine sunması gerekir. İlaç otoriteleri de değerlendirme yaptıktan sonra bunu kamuoyuna bildirmek zorundadır.
Fayda–risk analizinin temel yönleri
Temel terimler
Fayda (Benefit): Enfeksiyonu tedavi etmek, kan basıncını kontrol etmek veya yaşam kalitesini artırmak gibi pozitif/terapötik etkiler.
Risk (Risk): Zarar potansiyeli; hafif yan etkileri (örn. mide rahatsızlığı) ve ciddi advers olayları (örn. organ hasarı, hastaneye yatış) kapsar.
Belirsizlik (Uncertainty): Bir ilacın fayda veya risklerine ilişkin bilinmeyenler; özellikle ürün piyasaya çıktıktan sonra ortaya çıkanlar.
Analizde dikkate alınan faktörler
Şiddet ve sıklık: Tedavi edilen hastalığın ciddiyeti, potansiyel yan etkilerin ağırlığı ve görülme sıklığıyla birlikte tartılır. Güvenliği tartışmalı bir ilaç, kanser gibi ağır hastalıklarda kabul edilebilirken, daha hafif durumlarda kabul edilmeyebilir.
Hasta popülasyonu: Fayda–risk dengesi farklı gruplar için değişebilir. Genel nüfus için kabul edilebilir bir risk, hamileler gibi kırılgan gruplar için kabul edilemez olabilir.
Mevcut alternatifler: Daha elverişli fayda–risk profiline sahip başka tedavilerin bulunması, düzenleyiciler için kritik bir husustur.
Hasta bakışı: Hastaların tercih ve algıları—hastalığın süresi, şiddeti ve tedavi deneyimine göre değişebilen—gittikçe daha önemli girdiler olarak kabul edilmektedir.
Kimler yapar ve ne zaman yapılır?
Fayda–risk analizi, bir ilacın her aşamasında yürütülür.
Ruhsat onayından önce
İlaç geliştiricileri (sponsorlar): Klinik çalışmalarda gerekli verilerin toplanmasını sağlamak üzere erken aşamada fayda–risk planlamasına başlar.
Düzenleyici otoriteler (örn. FDA, EMA, TİTCK): Pazarlama yetkisi vermeden önce nihai fayda–risk değerlendirmesini yapar; belirtilen endikasyon için faydaların bilinen riskleri aştığına dair ikna edici kanıt arar.
Ruhsat onayından sonra
Düzenleyiciler: Ürün piyasadayken de fayda–risk dengesini izlemeye devam eder. Örneğin EMA, firmalardan Periyodik Fayda–Risk Değerlendirme Raporları (PBRER) sunmalarını ister. Süreç dinamiktir; yeni güvenlik verileri çıkarsa yetkililer ruhsat koşullarını revize edebilir veya ürünü geri çekebilir.
Sağlık profesyonelleri: Her hasta için, kişinin benzersiz klinik durumunu dikkate alarak fayda ve riskleri sürekli tartar.
Hastalar: Hekimleriyle ortak karar verme sürecine katılır; potansiyel faydaları kendi risk toleransları ile dengeler.
Nitel (kalitatif) ve nicel (kantitatif) yöntemler
Bazı fayda–risk değerlendirmeleri klinik kanaat ve nitel çerçevelere dayanırken, diğerleri sonuçları tartmak için daha katı nicel yöntemler kullanır.
Nitel/Tanımlayıcı: FDA’nın kullandığı türden yapılandırılmış nitel yaklaşımlar, değerlendirmenin kanıtlarını ve belirsizliklerini açık şekilde iletir.
Nicel: Nicel Fayda–Risk Değerlendirmesi (qBRA), çıktılara açık ağırlıklar vererek resmî bir analiz üretir. Örnek: Q-TWiST (Quality-Adjusted Time Without Symptoms and Toxicity), bir tedaviyle semptomsuz/geç toksisitesiz kazanılan zaman ile yan etkiler nedeniyle kaybedilen zamanı karşılaştırmalı olarak ölçer.
FDA'nın Yeni İlaç Uygulamalarının Pazar Öncesi Fayda-Zarar Değerlendirmesine İlişkin Temel Hususlar:
Durum (Hastalık) Analizi
Önemli Hususlar
- Önerilen endikasyonun kullanım bağlamı: amaçlanan tıbbi kullanım, hedef hasta popülasyonu
- Hastalığın ilgili klinik özellikleri
- Hastaya odaklı hastalık yükü
Başlıca Belirsizlik Kaynakları
- Hedef popülasyonun tanımlanabilirliği
- Hastalığın karmaşıklığı (örn. ilacın etki mekanizmasını anlamaya etkisi)
- Hastalık yüküne dair hasta girdisinin kapsamı
BRF Bölümü: Mevcut Tedavi Seçenekleri
Önemli Hususlar
- Mevcut standart tedavinin hedefleri
- Eri şilebilir tedavilerin etkililiği ve güvenliği
- Tedavi yükü (örn. uygulama şekli/sıklığı)
- Mevcut tedavilerin karşılamadığı hastalık yükü yönleri
- Hastaların tedavileri kullanma/benimseme düzeyi
Başlıca Belirsizlik Kaynakları
- Endikasyon için FDA onaylı olmayan tedavilere ilişkin kanıtların kapsamı
- Karşılanmamış ihtiyaçlara dair hasta girdisinin kapsamı
- BRF Bölümü: Fayda (Benefit)
Önemli Hususlar
- Klinik çalışmanın güçlü/zayıf yönleri: ilacın etkililiğini değerlendirmeye olası etkileri
- Çalışma sonlanımlarının klinik anlamlılığı: hastalar için önemli sonuçları ölçme/öngörme kapasitesi
- Gösterilen sonuçlar ve klinik önemi; şu unsurlarla bilgilendirilmiş olarak:
• Etki büyüklüğü ve süresi
• Faydaların niteliği (örn. hastalık modifiye edici, semptom azaltıcı)
• Etkinin çalışma popülasyonundaki dağılımı
• Gelecekteki klinik sonuçlara etkisi (örn. ölüm, organ hasarı)
• Hangi hastaların fayda görebileceğini öngörebilme
• Hasta/hekim açısından bireysel faydayı değerlendirebilme
• Faydaya ilişkin hasta görüşleri - Klinik kanıtların pazara sunulacak gerçek popülasyona (pazarlama sonrası ortam) genellenebilirliği
Başlıca Belirsizlik Kaynakları
- Program/deney tasarımı (örn. iki randomize kontrollü çalışma olmaması, tek kollu tasarım, gözlemsel veri kullanımı)
- İstatistiksel belirsizlik
- Çalışma sonlanımı ile klinik sonuçlar arasındaki ilişki
- Beklenen faydanın önemine dair hasta girdisinin kapsamı
- Klinik çalışmalarda yer almayan/az temsil edilen popülasyonlar
- Veri kalitesi ve bütünlüğü
BRF Bölümü: Risk ve Risk Yönetimi
Önemli Hususlar
- Güvenlik değerlendirmesinin güçlü/zayıf yönleri: risk değerlendirmesine olası etkileri
- Ciddi advers olaylar veya güvenlik sinyalleri—kalan belirsizliklerle birlikte klinik önemleri; şu açılardan:
• Zararların büyüklüğü, süresi, şiddeti
• Zararın geri döndürülebilirliği (örn. tedavi kesilince)
• Zararların çalışma popülasyonundaki dağılımı
• Gelecekteki klinik sonuçlara etkisi (örn. ölüm, organ hasarı)
• Hangi hastaların risk altında olabileceğini öngörebilme
• Zararları önleme, saptama ve azaltma becerisi
• Risklere ilişkin hasta görüşleri - Tolere edilebilirliği/uyumu etkileyebilecek advers etkiler (örn. bulantı)
- Ürün kalitesi veya cihaz sorunlarının etkililik/güvenliğe potansiyel etkisi
- Pazar sonrası ortamda reçeteleme ve gerçek kullanımın, klinik çalışma ortamından farklı olmasına bağlı ek güvenlik meseleleri
- Risk yönetimi stratejilerinin etkililiği
Başlıca Belirsizlik Kaynakları
- Güvenlik popülasyonunun büyüklüğü; tedavi gören popülasyonda olayın arka plan hızı (çalışmalar tüm riskleri saptamak için yetersiz güce sahip olabilir)
- Güvenlik sonlanımları ile klinik sonuçlar arasındaki ilişkinin anlaşılması
- Klinik çalışmalarda yer almayan/az temsil edilen duyarlı gruplar (örn. yaşlılar, komorbid hastalar)
- Veri kalitesi ve bütünlüğü
- Nitelikli sağlık hizmetine erişimdeki güçlükler/engeller
- Test edilmemiş risk yönetimi stratejileri
- Geliştirme partisindeki ürün ile ticari ölçek arasındaki olası farklar
BRF Bölümü: Fayda–Risk Hakkındaki Sonuçlar
Önemli Hususlar
- Terapötik bağlamın, faydalar için eşik değerini ve risk/belirsizliğe toleransı nasıl etkilediği
• Fayda ve risk değerleri ile bunlar arasındaki ödünleşimler (hasta görüşleri dâhil)
• Ürünün onaylanması hâlinde tedavi cephaneliğini nasıl güçlendirebileceği - Çözülememiş belirsizliklerin önemi
- Olumlu fayda–risk değerlendirmesini desteklemek için etiketleme gereksinimi (örn. kutu uyarı) veya REMS ihtiyacı
- Belirsizliği gidermek için pazarlama sonrası kanıta duyulan ihtiyaç
Başlıca Belirsizlik Kaynakları
- Fayda ve risk değerleri ile ödünleşimleri hakkında hasta ve diğer paydaş girdisinin kapsamı
- Pazar sonrası ortamda istenen güvenlik/fayda kanıtını üretebilme (örn. RCT’ler veya gözlemsel çalışmalar yoluyla) kapasitesi
TEMEL REFERANSLAR
- Risk and benefit analysis of medicines, A. Kumar, J Int Med Res. 2018 Aug 23;48(2):0300060518793548
- Value in Health, Volume 26, Issue 4, April 2023, Pages 449-460
- Drug and Therapeutics Bulletin 1995;33:33-
- https://dtb.bmj.com/content/33/5/33: Risk:benefit analysis of drugs in practice
- https://healthpolicy.duke.edu/sites/default/files/2020-07/discussion_guide_b-r_assessment_may16_0.pdf







