BİYOEŞDEĞERLİK NEDİR?
Prof. Dr. F. Cankat Tulunay
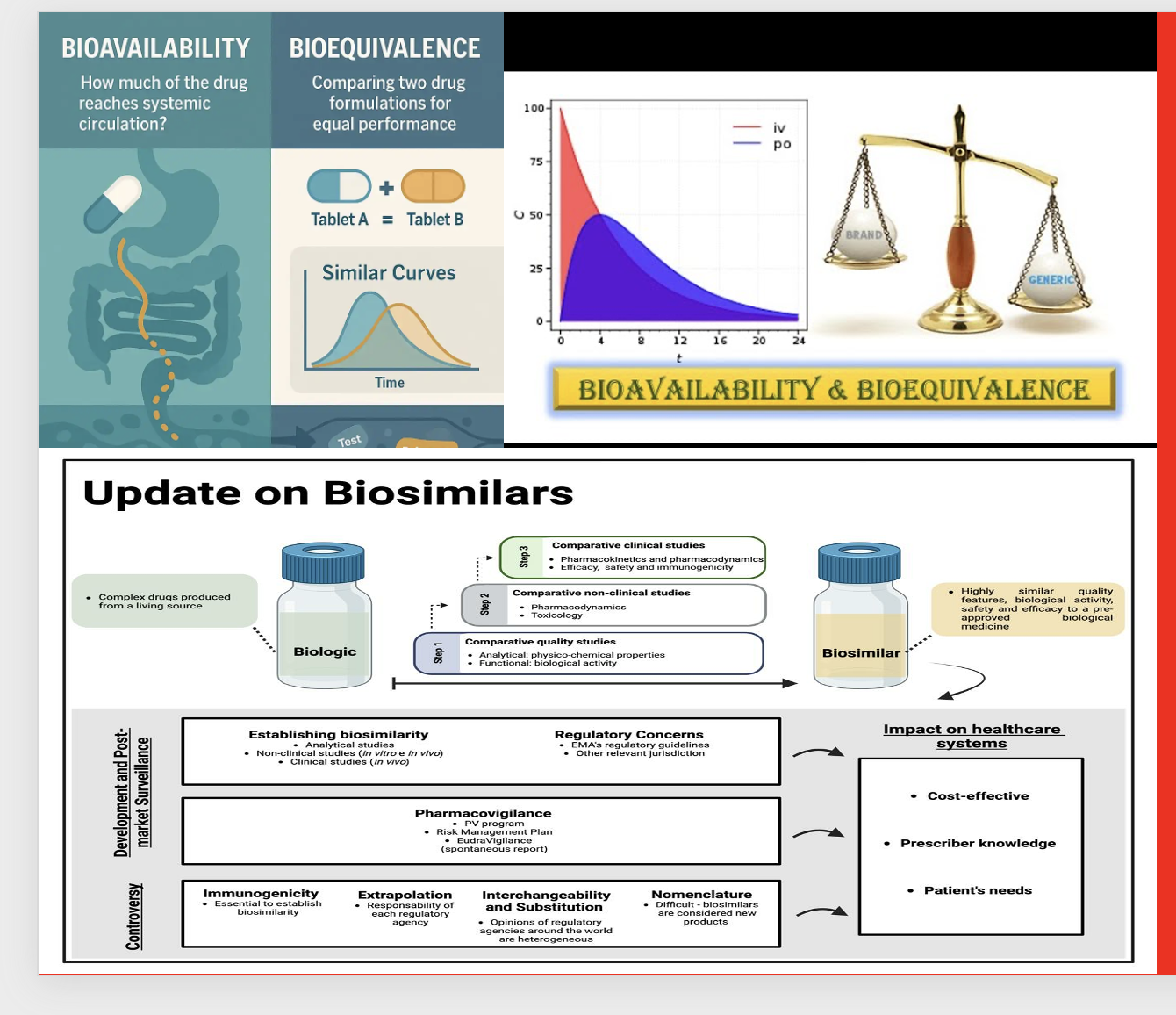
Biyoyararlanım (Bioavailability, BA), bir ilacın vücuda verildiği farmasötik şekilden emilerek sistemik dolaşıma geçen kısmının ve bu geçişin hızının ölçüsüdür. Başka bir deyişle, ilacın vücutta dolaşıma ne kadarının ulaştığını ve bu etkin maddenin hangi hızla ulaştığını gösterir. Biyoyararlanım genellikle plazmadaki ilaç derişimi–zaman eğrisi üzerinden hesaplanır. Bu eğriden elde edilen parametreler arasında en önemlileri, AUC (alan altında kalan eğri, toplam maruziyeti gösterir), Cmax (en yüksek plazma derişimi) ve Tmax (bu doruk değere ulaşma süresi)’dir. Biyoyararlanım iki şekilde değerlendirilir:
- Mutlak biyoyararlanım, ağızdan verilen bir ilacın dolaşıma geçen kısmının intravenöz uygulamaya göre kıyaslanmasıdır.
- Bağıl biyoyararlanım ise aynı etkin maddenin farklı farmasötik formları (örneğin tablet vs. süspansiyon) arasındaki karşılaştırmadır.
Biyoeşdeğerlik (Bioequivalence, BE) ise, aynı etkin maddeyi aynı dozda içeren iki farmasötik ürünün (örneğin bir orijinal ilaç ile jeneriği), benzer koşullar altında verildiğinde, biyoyararlanımları açısından klinik olarak anlamlı bir fark göstermemesi durumudur. Başka bir ifadeyle, bu iki ürünün vücutta emilim hız ve derecelerinin istatistiksel olarak birbirine eşdeğer olduğunun gösterilmesidir. Bu değerlendirme için, farmakokinetik parametreler olan AUC ve Cmax değerlerinin %90 güven aralığının genellikle %80–125 sınırları içinde bulunması aranır.
Biyoeşdeğerlik çalışmaları, özellikle jenerik ilaçların ruhsatlandırılmasında temel kriterdir; çünkü böylece jenerik ürünün orijinal ilaçla aynı etkinliği ve güvenliği sağlayacağı kanıtlanmış olur.
Biyoyararlanım ve biyoeşdeğerlik çalışmaları ABD’de 1970’lerde, Avrupa’da ise 1980–1990’larda sistematik hale geldi. ABD daha erken başlamış, Avrupa ise EMA’nın kurulmasıyla merkezi hale getirlmiştir. Türkiyede ‘’BIOAVAILABITY’’ kavramı ilk defa tarafımdan 1976 yılında ‘’BİYOLOJİK YARARLILIK’’ olarak tanımlanmış ve daha sonra Prof. Dr. Oğuz Kayaalp tarafından ‘’BİYOYARARLANIM’’ terimi tavsiye edilmiş ve bioavailabilytinin Türkçesi olarak kabul edilmiştir (TULUNAY,F.C.: İlaçların plazma konsantrasyonları ile etkileri arasındaki ilişki. ‘’Kardiyovasküler Hastalıklarda İlaç Tedavisi’’, Eds.F.C.Tulunay, I.H.Ayhan, S.Kaymakçalan, Agaç Is Basım, Ankara, pp l-24, 1976’’). O tarihten itibaren gerek Türk Farmakoloji Derneği, gerekse Klinikfarmakoloji Derneği bünyesinde yapılan çeşitli bilimsel toplantılarda biyoeşedeğerlik çalışmalarının Türkiyede de jenerik ilaçlar için mecbut tutulması yönünde büyük çaba harcadık. Başlangıçta özellikle yerli ilaç sanayiinin büyük tepkisi ve hatta tehditleri ile karşılaştık.
Türkiye’de biyoyararlanım (BA) ve biyoeşdeğerlik (BE) kavramları, dünyadaki gelişmelerden yaklaşık on yıl sonra gündeme girmiştir. 1980’lerde ruhsatlandırma süreçlerinde BE zorunluluğu yokken, 1990’lı yılların ortalarından itibaren Sağlık Bakanlığı jenerik ilaç ruhsatlarında biyoeşdeğerlik raporu talep etmeye başlamıştır. Ancak o dönemde ülkede bu çalışmaları yapabilecek bir altyapı bulunmamaktaydı.
Bu boşluğu doldurmak amacıyla Türkiye’nin ilk biyoeşdeğerlik merkezi olan AKFAK (Ankara Klinik Farmakoloji Araştırma Merkezi) Prof. Dr. F. Cankat Tulunay tarafından kurulmuştur. AKFAK, Türkiye’de BA/BE çalışmalarının yerli olarak yapılabilmesine imkân tanımış ve hem akademik hem de sektörel düzeyde bir dönüm noktası olmuştur. Bu girişim, Türkiye’nin jenerik ilaç sektöründe uluslararası standartlarla uyumlu hale gelmesinin önünü açmıştır. AKFAK tarafından Türkiyenin ilk biyoyararlanım çalışması (Tulunay FC, Onaran HO, Ergün H, Ucar A, Usanmaz S, Embil K, Tulunay M.: Pharmacokinetics of phenprobamate after oral administration to healthy subjects. Arzneimittelforschung. 1998 Nov;48(11):1068-7) yapılmıştır. Tarafımızdan Türkiyenin ilk biyoeşdeğerlik çalışması DEVA firması için Ampicilline-Amoxicilline ile yapılmış ve DEVA bu çalışmayı Avrupa ruhsat müracaat dosyasına koymuştur. Daha sonra içimizden birisinin şikayeti üzerine İEG Müdürü Kemalettin Akalın tarafından özel jeneratör bulunmadığı için (binanın merkezi jeneratörü olmasına ragmen) 4-5 çalışmadan sonra AKFAK faaliyetleri durduruldu (Kemalettin Akalın emekli olduktan sonra yasak kararının kimin baskısı ile alındığını anlatıp, pişmanlığını belirtmiştir). Türkiyede biyoyararlanım-biyoeşdeğerlik yapılması aşamalarını öetlersek:
.1. İlk Dönem (1980’ler – 1990’lar başı)
- 1980’lerde dünyada jenerik ilaçların ruhsatlandırılmasında biyoeşdeğerlik şartı gündeme gelirken, Türkiye’de ruhsat başvuruları ağırlıklı olarak farmasötik kalite belgeleri (etkin madde, saflık, çözünme hızı) üzerinden değerlendiriliyordu.
- BA/BE çalışmaları sistematik bir zorunluluk değildi.
2. 1990’lar: İlk Düzenlemeler
- 1994–1995 yıllarında Türkiye’de Sağlık Bakanlığı jenerik ilaçlarda biyoeşdeğerlik raporu talep etmeye başladı.
- Bu dönemde ilk çalışmalar yukarıda bahsedildiği gibi AKFAK tarafından yapılmış ve diğer Üniversitelere de örnek olmuştur.
- Ancak o dönemde ülkede BA/BE yapabilecek yeterli merkez yoktu; çoğu firma çalışmalarını yurtdışında (özellikle Hindistan ve Avrupa’daki CRO’larda) yaptırıyordu.
3. 2000’ler: Mevzuatın Netleşmesi
- 2001 tarihli “Beşeri Tıbbi Ürünlerin Ruhsatlandırılmasına Dair Yönetmelik” ile BA/BE çalışmaları Türkiye’de yasal zorunluluk haline geldi.
- Sağlık Bakanlığı ve daha sonra TİTCK (Türkiye İlaç ve Tıbbi Cihaz Kurumu) kılavuzları EMA/FDA kriterleriyle uyumlu hale getirildi.
- BA/BE merkezleri kurulmaya başladı; Hacettepe, Ankara, Marmara ve Ege üniversiteleri gibi
4. 2010 sonrası: Uluslararası Uyum
- TİTCK, EMA’nın 2010 ve sonraki BE kılavuzlarını esas alarak ulusal rehberler hazırladı.
- Türkiye’de yapılan BA/BE çalışmaları GLP ve GCP standartlarına uymak zorunda hale geldi.
- 2010’ların ortasından itibaren Türkiye’de çok sayıda özel ve üniversite merkezli BA/BE araştırma merkezi (CRO) faaliyet göstermeye başladı.
- Bugün Türkiye, jenerik ilaç sektörünün büyüklüğü nedeniyle düzenli ve zorunlu BE çalışması yapılmaktay sa da halen biyoeşdeğerliği veya biyoyararlanımı bilinmeyen ilaçlar kullanılabilmektedir.
ABD’de (FDA)
-
1962 Kefauver–Harris Amendment (ABD İlaç Yasası değişikliği): İlaçların sadece güvenli değil, aynı zamanda etkin olduklarının da kanıtlanmasını şart koştu. Bu, biyoyararlanım çalışmalarına zemin hazırladı.
- 1970’ler başı: FDA, özellikle dar terapötik aralıklı ilaçlarda (örn. antiepileptikler, digoksin) plazma konsantrasyonu ölçümlerini ve biyoyararlanım testlerini talep etmeye başladı.
- 1977: FDA Bioavailability and Bioequivalence Regulations yayımladı, biyoyararlanım ve biyoeşdeğerlik kavramları yasal olarak netleşti.
- 1984 Hatch–Waxman Act: Jenerik ilaçların ruhsatı için biyoeşdeğerlik ispatı temel koşul haline geldi. Bugünkü sistemin omurgasıdır.
Avrupa’da (EMA ve öncesi ulusal ajanslar)
- 1970’ler ortası: Avrupa’da da benzer şekilde biyoyararlanım ölçümleri gündeme geldi, ancak ülkeler arasında farklı uygulamalar vardı (Almanya, İngiltere, Fransa ayrı rehberler yayımlıyordu).
- 1980’ler: EEC (Avrupa Ekonomik Topluluğu) ilaç regülasyonlarını uyumlaştırma sürecine girdi. Jenerik ruhsatlarda biyoeşdeğerlik şartı kademeli olarak getirildi.
- 1992: Avrupa İlaç Ajansı (EMA) kuruldu, biyoyararlanım ve biyoeşdeğerlik çalışmaları için ortak kriterler benimsendi.
- 2001/83/EC Direktifi: Avrupa’da jenerik ilaç ruhsatı için biyoeşdeğerlik kanıtı zorunlu hale geldi.
- Sonraki rehberler (2001, 2010, 2017): BE çalışmaları için ayrıntılı teknik kılavuzlar güncellendi
EMA Bioequivalence Guidelines
1. 2010 Kılavuzu (Guideline on the Investigation of Bioequivalence, CPMP/EWP/QWP/1401/98 Rev. 1)
- Temel çerçeve:
- Jenerik ilaçların onayı için BE çalışmalarının nasıl yapılacağını standartlaştırdı.
- BA/BE için plazma konsantrasyon-zaman eğrisinden AUC (alan altında kalan eğri) ve Cmax (maksimum konsantrasyon) parametrelerinin karşılaştırılması şart koşuldu.
- İstatistiksel kriterler:
- BE sınırları: %90 güven aralığı 80–125% (AUC ve Cmax için).
- Özel durumlar:
- Dar terapötik aralıklı ilaçlar (antiepileptikler, immünsupresanlar) için daha sıkı izlem önerildi.
- Uzatılmış salımlı (modified release) formlar için ek gereklilikler tanımlandı.
- Tüketim koşulları:
- Açlık ve tok karnına çalışma zorunluluğu getirildi (ilaç özelliklerine bağlı).
2. 2017 Revizyonu (EMA Bioequivalence Guideline – Addendum for Narrow Therapeutic Index Drugs and Highly Variable Drugs)
- Dar terapötik indeksli ilaçlar (NTIDs) için değişiklik:
- AUC için BE sınırları 90–111%’e daraltıldı.
- Cmax için daha sıkı değerlendirme istenir hale geldi.
- Yüksek değişkenlik gösteren ilaçlar (Highly Variable Drugs, HVDs):
- %30’dan fazla intra-individual varyasyon gösteren ilaçlar için scaled average bioequivalence (SABE) yöntemi getirildi.
- Bu sayede çok büyük hasta gruplarına gerek kalmadan BE gösterilebilmesi sağlandı.
- Farmakodinamik ve klinik sonlanımlar:
- Ölçülemeyen ilaçlar için (ör. topikal formülasyonlar) daha net PD ve klinik sonlanım kılavuzları tanımlandı.
- İmmünojenisite ve biyolojik ürünler:
- Biyolojik/biyobenzer ürünlerde klasik BE yaklaşımının sınırlılıklarına dikkat çekildi, ek gereklilikler vurgulandı.
Bir biyolojik ürünün “biosimilar” olabilmesi için referans ürüne aynı etkiyi, güvenliği ve kaliteyi klinik olarak anlamlı fark olmadan gösterebilmesi mutlak şarttır. Bunun için molekül düzeyinden klinik etkinliğe kadar çok katmanlı karşılaştırma yapılır; sadece klinik çalışma yapmak yeterli değildir.
Aşağıda bir ürünün biyobenzer (biosimilar) olarak kabul edilebilmesi için EMA (European Medicines Agency) ve FDA gibi düzenleyici otoritelerin tanımladığı mutlak şartlar vardır. Bunlar kısaca şöyledir:
1. Referans Ürünle İlişki
- Biyobenzer ürün mutlaka daha önce ruhsat almış ve pazarda olan bir referans biyolojik ürüne dayanmalıdır.
- Aynı endikasyon, aynı dozaj formu ve aynı uygulama yolu üzerinden karşılaştırılır.
- Referans ürün genellikle AB’de (EMA için) veya ABD’de (FDA için) ruhsatlı olmalıdır.
2. Molekülün Karakterizasyonu
- Amino asit dizisi referans ürünle aynı olmalıdır.
- Ürünün üç boyutlu yapısı, post-translasyonel modifikasyonları (ör. glikozilasyon) ayrıntılı şekilde analiz edilmeli ve referans ürünle yüksek derecede benzerlik göstermelidir.
- Küçük farklılıklar olabilir, fakat bu farklılıkların klinik anlamlı etkisi olmaması gerekir.
3. Üretim Süreci
- Biyobenzer ilaç, tamamen yeni bir hücre hattında üretilir. Orijinal üretim sürecine erişim yoktur.
- Bu nedenle üretim süreci standartlara uygun kalite kontrol ve iyi imalat uygulamaları (GMP) ile belgelenmelidir.
- İmalat süreci değişiklikleri ürünün biyobenzerliğini bozmayacak şekilde tasarlanmalı ve validasyonu yapılmalıdır.
4. Klinik Öncesi ve Klinik Çalışmalar
- Adım adım kanıt zinciri (totality of evidence) yaklaşımı zorunludur:
- Analitik benzerlik çalışmaları (fizikokimyasal, biyolojik aktivite).
- Non-klinik çalışmalar (in vitro, sınırlı hayvan verileri).
- Klinik farmakokinetik (PK) ve farmakodinamik (PD) karşılaştırmaları.
- Klinik etkinlik ve güvenlilik çalışmaları, seçilmiş duyarlı endikasyonlarda.
- Amaç, “referans ürünle klinik olarak anlamlı bir fark yoktur”u göstermek, non-inferiority veya equivalence ispatlamaktır.
5. Endikasyonların Ekstrapolasyonu
- Eğer bir endikasyonda biyobenzerlik gösterilmişse, uygun bilimsel gerekçeyle referans ürünün diğer endikasyonlarına da ruhsat uzatılabilir.
- Ancak bu, mekanizma, immünojenisite ve güvenlik profili açısından güçlü biyolojik gerekçe gerektirir.
6. İmmünojenisite
- Her biyolojik ürün potansiyel olarak bağışıklık yanıtı oluşturabilir.
- Bu nedenle biyobenzer ürünlerde immünojenisite karşılaştırması klinik geliştirme programının temel şartıdır.
- Antikor gelişimi, nötralizan/non-nötralizan antikorlar, klinik sonuçlara etkisi mutlaka değerlendirilir.
7. Farmakovijilans ve Risk Yönetimi
- Pazara çıktıktan sonra biyobenzer ürünler için risk yönetim planı ve farmakovijilans programı uygulanmalıdır.
- Referans ürünle benzer güvenlilik profilini izlemek için post-marketing çalışmalar zorunludur.
SONUÇ:
Bir biyolojik ürünün “biosimilar” olabilmesi için referans ürüne aynı etkiyi, güvenliği ve kaliteyi klinik olarak anlamlı fark olmadan gösterebilmesi mutlak şarttır. Bunun için molekül düzeyinden klinik etkinliğe kadar çok katmanlı karşılaştırma yapılır; sadece invitro testler veya klinik çalışma yapmak yeterli değildir.
KLİNİSYENLER İÇİN BİYOEŞDEĞERLİK REHBERİ EKLİ DOSYADA SUNULMUŞTUR:
BİYOEŞDEĞERLER (Biosimilars): Klinisyenler için Healio® Rehberi
SPECIAL REPORT:
A Healio® Guide for Clinicians
Contributors: Madelaine Feldman, MD, FACR • Allan Gibofsky, MD, JD, MACR, FACP , FCLM Molly Grammel, JD • Yaniv Heled, JSD • Eric T. Roberts, PhD, MPH
Written by: Justin Cooper
© Healio 2025 / Biosimilars: A Healio® Guide for biosimilars







